JOSEPH LOUIS GAY LUSSAC
Gay-Lussac nasceu em Saint-Léonard-de-Noblat. (6 de dezembro de 1778) e morreu em Paris (9 de maio de 1850). Químico e físico francês. Professor de Física da Sorbonne e de Química na Escola Politécnica.
Foi, acima de tudo um grande observador, trabalhando infatigavelmente pelo progresso da ciência em benefício da humanidade.
Em 1797, entrou na Escola Politécnica em Paris e graduou-se em 1800. Começou estudos adicionais em engenharia, mas se afastou em 1801 quando foi convidado a ser assistente do distinto químico Claude-louis Berthollet. Muitas das pesquisas de Lussac foram realizadas no laboratório localizado na casa de campo de Berthollet em Arcueil, perto de Paris. Esta aldeia era o centro de um grupo ativo de jovens cientistas orientados por Berthollet e Pierre-Simon Laplace.
Em 1802, elaborou uma lei, conhecida como a lei de Charles, que trata dos efeitos da temperatura sobre os gases. Mostrou que todos os gases expandem proporcionalmente ao aumento de temperatura. A existência de um coeficiente térmico de expansão comum tornou possível a definição de uma nova escala de temperatura de profundo significado termodinâmico estabelecida posteriormente por Sir William Thomson (Lord Kelvin).
Em 24 de agosto de 1804, juntamente com Jean Baptiste Biot ascenderam num balão de hidrogênio a uma altura de 4000m a fim de estudar a variação magnética da Terra em relação à altura. Realizou sozinho uma segunda ascensão em 16 de setembro do mesmo ano, a uma altura recorde de 7016m com objetivo de repetir medições magnéticas, estudar a variação da temperatura e pressão e coletar amostras de ar.
Em 1805, em companhia de Humboldt, fez uma expedição científica à Itália, estagiando depois algumas semanas no laboratório de Humboldt, em Berlim. Experiências mostraram a determinação de proporções relativas em hidrogênio e oxigênio devem ser combinados para formar água.
Assim, em 31 de dezembro de 1808, ano de seu casamento, anunciou a lei da combinação dos volumes. Esta lei estabelece que os gases formam compostos entre si, segundo proporções definidas, que podem ser expressas em fórmulas. A fórmula usada para a água (H2O) mostra que a água é formada por duas partes de hidrogênio (H) e uma parte de oxigênio (O).
Aperfeiçoou os processos de fabricação do ácido sulfúrico e do ácido oxálico para a indústria. Sugeriu um método de determinação da quantidade de álcalis existente na potassa e no carbonato de sódio (barrilha), além de aperfeiçoar meios de avaliar a quantidade de cloro contida no pó de descoramento, ou alvejamento. Gay-Lussac e Louis Jacques Thenard, trabalhando independentemente, isolaram o boro, no mesmo ano (1808) que sir Humphrey Davy, químico inglês, o fazia na Inglaterra. Em 1809, depois de tentar a análise do cloro, que se chamava então "ácido muriático oxigenado", concluiu que havia motivo para se ver nele um corpo simples. Em 1815, descobriu o cianogênio e o ácido prússico. Em 1816, construiu o barômetro de sifão que tem seu nome; a seguir, o seu alcoômetro centesimal.
Por sua notável contribuição para o progresso da química, foi eleito para a Académie des Sciences, de Paris, e para a Royal Society, de Londres.Lei volumétrica, onde ele afirma que nas mesmas condições de temperatura e pressão, os volumes dos gases participantes de uma reação têm entre si uma relação de números inteiros e pequenos.
A lei de Gay Lussac
A lei de Gay-Lussac diz respeito à reação dos gases entre si, e os volumes são medidos nas mesmas condições de pressão e temperatura, existe também, uma razão de números inteiros, geralmente pequenos, existentes entre os volumes dos gases reagentes e os produtos de reação.
Primeiro exemplo (todos os gases)
1 N2 + 3 H2 → 2 NH3
1VN2 : 3V H2 : 2VNH3
Segundo exemplo (todos os gases)
2C4H10 + 13O2 → 8CO2 + 10H2O
2VC4H10 : 13VCO2 : 8VCO2 : 10VH2O
Caso a água esteja no estado líquido, vale apenas:
2VC4H10 : 13VO2 : 8VCO2
Contração de volume (em reação entre gases)
A diferença entre a soma dos volumes dos gases reagentes e o volume do gás resultante, é a contração.
C = S – V
Onde:
Primeiro exemplo (todos os gases)
1 N2 + 3 H2 → 2 NH3
1VN2 : 3V H2 : 2VNH3
Segundo exemplo (todos os gases)
2C4H10 + 13O2 → 8CO2 + 10H2O
2VC4H10 : 13VCO2 : 8VCO2 : 10VH2O
Caso a água esteja no estado líquido, vale apenas:
2VC4H10 : 13VO2 : 8VCO2
Contração de volume (em reação entre gases)
A diferença entre a soma dos volumes dos gases reagentes e o volume do gás resultante, é a contração.
C = S – V
Onde:
S = soma dos volumes dos gases que se combinam.
V = volume do gás resultante.
A fração do volume inicial que diminui é a contração relativa.
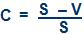
Exemplo:

V = volume do gás resultante.
A fração do volume inicial que diminui é a contração relativa.
Exemplo:

esperamos que tenham gostado até a próxima.


Nenhum comentário:
Postar um comentário